Silicium
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
[Ne] 3s2 3p2 14Si Periodensystem | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Name, Symbol, Ordnungszahl | Silicium, Si, 14 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Serie | Halbmetalle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Gruppe, Periode, Block | 14, 3, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Aussehen | dunkelgrau, bläulicher Farbton | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
CAS-Nummer | 7440-21-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 25,8 %[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Atommasse | 28,085 (28,084–28,086)[3][4]u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Atomradius (berechnet) | 110 (111) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Kovalenter Radius | 111 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Van-der-Waals-Radius | 210 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Elektronenkonfiguration | [Ne] 3s2 3p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 786,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 1577,1 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 3231,6 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 4355,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Kristallstruktur | Diamantstruktur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dichte | 2,336 g/cm3(20 °C)[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Mohshärte | 6,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Magnetismus | diamagnetisch (Χm = −4,1 · 10−6)[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Schmelzpunkt | 1683 K (1410 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Siedepunkt | 3533 K[7] (3260 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Molares Volumen | 12,06 · 10−6 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Verdampfungswärme | 383 kJ/mol[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Schmelzwärme | 50,66[8] kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Schallgeschwindigkeit | 8433 m/s bei 293 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Spezifische Wärmekapazität | 703[1] J/(kg · K) bei 298 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Elektrische Leitfähigkeit | 2,52 · 10−4 A/(V · m) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Wärmeleitfähigkeit | 150 W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Oxidationszustände | −4, (2) +4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Oxide (Basizität) | SiO2 (amphoter) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Elektronegativität | 1,90 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
MAK | Schweiz: 3 mg·m−3 (gemessen als alveolengängiger Staub)[10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Silicium
Silicium, auch Silizium, ist ein chemisches Element mit dem Symbol Si und der Ordnungszahl 14. Es steht in der 4. Hauptgruppe (Kohlenstoffgruppe), bzw. der 14. IUPAC-Gruppe, und der 3. Periode des Periodensystems der Elemente. In der Erdhülle ist es, auf den Massenanteil (ppmw) bezogen, nach Sauerstoff das zweithäufigste Element.
Silicium ist ein klassisches Halbmetall, weist daher sowohl Eigenschaften von Metallen als auch von Nichtmetallen auf und ist ein Elementhalbleiter. Reines, elementares Silicium besitzt eine grau-schwarze Farbe und weist einen typisch metallischen, oftmals bronzenen bis bläulichen Glanz auf.
Elementares Silicium ist für den menschlichen Körper ungiftig, in gebundener silicatischer Form ist Silicium für den Menschen wichtig. Der menschliche Körper enthält etwa 20 mg/kg Körpermasse Silicium; die Menge nimmt mit zunehmendem Alter ab.
Inhaltsverzeichnis
1 Schreibweise und Etymologie
2 Geschichte
2.1 Nutzung in vorindustrieller Zeit
2.2 Entdeckung als Element
3 Vorkommen
3.1 Silicium in der unbelebten Natur
3.2 Silicatkreislauf
3.3 Silicium in der belebten Natur
4 Physiologische Bedeutung für den Menschen
5 Gewinnung im Labor
6 Gewinnung in der Industrie
6.1 Rohsilicium
6.2 Solarsilicium
6.3 Halbleitersilicium
6.4 Hersteller
7 Eigenschaften
7.1 Physikalische Eigenschaften
7.2 Chemische Eigenschaften
7.3 Mechanische Eigenschaften
8 Isotope
9 Sicherheit
10 Verwendung in der Technik
11 Verbindungen
12 Sonstiges
13 Siehe auch
14 Literatur
15 Weblinks
16 Einzelnachweise
Schreibweise und Etymologie
Standardsprachlich wird das Element ‚Silizium‘ geschrieben. Die Schreibweise mit ‚c‘ ist vor allem in der chemischen Fachsprache gebräuchlich. Beide Schreibweisen entstammen dem lateinischen Ausdruck silicia ‚Kieselerde‘, verknüpft mit lat. silex ‚Kieselstein‘, ‚Fels‘.[11]
Das englische Wort für Silicium ist silicon. Es ist zum Beispiel in der Bezeichnung Silicon Valley enthalten. Die gelegentlich anzutreffende Übersetzung Silikon ist ein falscher Freund, denn Silikone sind eine Klasse von chemischen Verbindungen des Siliciums.
Geschichte
Nutzung in vorindustrieller Zeit
Siliciumhaltige Verbindungen, vor allem Gesteine, spielen in der Menschheitsgeschichte als Baumaterial traditionell eine wichtige Rolle. Ein typisches Beispiel für ein frühes Bauwerk aus Stein ist Stonehenge. Ein weiteres wichtiges silicathaltiges Material, das seit langer Zeit als Baumaterial dient, ist Lehm, der zunächst im Astgeflecht-Lehmbau, später in Ziegelform verwendet wurde. Zement, der ebenfalls silicathaltig ist, wurde erstmals von den Römern entwickelt.
Aufgrund ihrer scharfen Schnittkanten fanden siliciumhaltige Gesteine in der Steinzeit auch Einsatz als Werkzeuge. Bereits in vorgeschichtlicher Zeit ist zum Beispiel Obsidian als besonders geeignetes Werkzeugmaterial abgebaut und durch Handel weithin verbreitet worden. Auch Feuerstein wurde in Kreidegebieten, etwa in Belgien und Dänemark, bergmännisch gewonnen. Bei der Metallgewinnung, insbesondere bei der Stahlherstellung, wird Silicat-Schlacke zum Schutz der Herde und Öfen vor Sauerstoffzutritt und als Form aus Ton oder Sand eingesetzt; dabei wurde möglicherweise die Glasherstellung entdeckt.
Entdeckung als Element

Antoine Lavoisier, postulierte die Existenz von Silicium
Zum ersten Mal wurde im Jahre 1789 von Antoine Lavoisier vorhergesagt, dass es sich bei Silex um das Oxid eines Metalles handelt.[12][13] Im Jahre 1807 postulierte Humphry Davy nach elektrochemischen Versuchen die Existenz der Metalle Silicium, Aluminium, Zirconium und Glucinium (Beryllium).[14]
“Had I been so fortunate as to have obtained more certain evidence on this subject, and to have procured the metallic substances I was in search of, I should have proposed for them the names of silicium, alumium, zirconium und glucium.”
„Wäre ich so glücklich gewesen, mehr zuverlässige Beweise zu diesem Thema zu erhalten und die metallischen Substanzen, die ich suchte, beigebracht hätte, hätte ich für sie die Namen Silicium, Alumium, Zirkonium und Glucium vorschlagen.“
Im Jahre 1811 stellten der Chemiker Joseph Louis Gay-Lussac und Louis Jacques Thénard (vgl. Thénards Blau) unreines und amorphes Silicium (a-Si, die nichtkristalline, allotrope Form des Siliciums) her.[15][16] Dazu setzten sie Siliciumtetrafluorid mit elementarem Kalium um. Ein ähnliches Vorgehen wurde 1824 von Jöns Jakob Berzelius in Schweden durch Umsetzung eines Hexafluorosilicates mit elementarem Kalium beschritten. Berzelius reinigte das so erhaltene amorphe Silicium durch Waschen. Er erkannte als erster die elementare Natur des Siliciums und gab ihm seinen Namen.[17]
Der Begriff Silicium leitet sich vom lateinischen Wort silex (Kieselstein, Feuerstein) ab. Er bringt zum Ausdruck, dass Silicium häufiger Bestandteil vieler Minerale ist.
Der englische Begriff silicon wurde 1817 von dem schottischen Chemiker Thomas Thomson (1773–1852) vorgeschlagen. Die Endung -on soll dabei auf die chemische Verwandtschaft zu den Nichtmetallen Kohlenstoff (carbon) und Bor (boron) hinweisen.[18]
Die erstmalige Herstellung reinen, kristallinen Siliciums gelang im Jahre 1854 dem französischen Chemiker Henri Etienne Sainte-Claire Deville mittels Elektrolyse.
Vorkommen
Silicium in der unbelebten Natur

Bergkristall aus SiO2
Die gesamte Erde besteht zu etwa 15 Massenprozent aus Silicium; insbesondere der Erdmantel setzt sich zu einem beträchtlichen Anteil aus silicatischen Gesteinsschmelzen zusammen. Die Erdkruste besteht zu etwa 25,8 Gewichtsprozent aus Silicium; damit ist es das zweithäufigste chemische Element nach dem Sauerstoff. Hier tritt Silicium im Wesentlichen in Form silicatischer Minerale oder als reines Siliciumdioxid auf.
So besteht Sand vorwiegend aus Siliciumdioxid. Quarz ist reines Siliciumdioxid. Viele Schmucksteine bestehen aus Siliciumdioxid und mehr oder weniger Beimengungen anderer Stoffe, etwa Amethyst, Rosen- und Rauchquarz, Achat, Jaspis und Opal. Mit vielen Metallen bildet Silicium Silicate aus. Beispiele für silicathaltige Gesteine sind Glimmer, Asbest, Ton, Schiefer, Feldspat und Sandstein. Auch die Weltmeere stellen ein gewaltiges Reservoir an Silicium dar: In Form der monomeren Kieselsäure ist es in allen Ozeanen in beträchtlichen Mengen gelöst. Insgesamt sind bisher (Stand: 2011) 1437 Siliciumminerale bekannt, wobei der seltene Moissanit mit einem Gehalt von bis zu 70 % den höchsten Siliciumanteil hat (zum Vergleich: Mineralischer Quarz hat einen Siliciumgehalt von bis zu 46,7 %).[19]
Da Silicium in der Natur auch in gediegener, das heißt elementarer Form vorkommt, ist es bei der International Mineralogical Association (IMA) als Mineral anerkannt und wird in der Strunz’schen Mineralsystematik (9. Auflage) unter der System-Nr. 1.CB.15 (8. Auflage: I/B.05-10) in der Abteilung der Halbmetalle und Nichtmetalle geführt. In der vorwiegend im englischen Sprachraum bekannten Systematik der Minerale nach Dana trägt das Element-Mineral die System-Nr. 01.03.07.01.
Gediegenes Silicium konnte bisher (Stand: 2011) an 15 Fundorten nachgewiesen werden, davon erstmals in der Lagerstätte Nuevo Potosí auf Kuba. Weitere Fundorte liegen in der Volksrepublik China, Russland, der Türkei und in den Vereinigten Staaten.[20]
Silicatkreislauf
Silicatische Mineralien werden permanent durch Reaktion mit der Kohlensäure des Wassers zu Metakieselsäure und Carbonaten abgebaut, wie am Beispiel des Calciumsilicats gezeigt werden kann:
- CaSiO3+H2CO3⟶CaCO3+SiO(OH)2{displaystyle mathrm {CaSiO_{3}+H_{2}CO_{3}longrightarrow CaCO_{3}+SiO(OH)_{2}} }
Die unlösliche Metakieselsäure reagiert weiter mit Kohlensäure zu löslicher Orthokieselsäure:
- SiO(OH)2+H2CO3⇌Si(OH)4+CO2{displaystyle mathrm {SiO(OH)_{2}+H_{2}CO_{3}rightleftharpoons Si(OH)_{4}+CO_{2}} }
Allerdings reagiert Orthokieselsäure mit sich selbst relativ schnell wieder zu (amorphem) Siliciumdioxid und Wasser, sofern der pH-Wert ≥ 3 ist. Die absolute Konzentration der Orthokieselsäure ist relativ gering (z. B. < ca. 7 mmol in Meerwasser).
Durch Einbau von Kieselsäure oder wasserlöslichen Silicaten in Meeresorganismen (1.), die nach dem Absterben auf den Meeresboden sedimentieren, oder durch Vulkanismus und Austritt von Magma am Meeresboden werden die silicatischen Mineralien wieder zurückgebildet (2.), und der Kreislauf ist geschlossen:
- 1.) Si(OH)4⟶SiO2+2 H2O{displaystyle 1.) mathrm {Si(OH)_{4}longrightarrow SiO_{2}+2 H_{2}O} }
- 2.) CaO+SiO2⟶CaSiO3{displaystyle 2.) mathrm {CaO+SiO_{2}longrightarrow CaSiO_{3}} }
Der Zeithorizont, in dem dieser Prozess stattfindet, beträgt mehrere Millionen Jahre, ist also beträchtlich länger als im Fall des Kohlenstoffkreislaufs der belebten Natur.
Silicium in der belebten Natur
Neben der bereits erwähnten essentiellen Natur des Siliciums gibt es eine Reihe von Lebewesen, die siliciumdioxidhaltige Strukturen erzeugen. Am bekanntesten sind dabei die Kieselalgen (Diatomeen), Schwämme (Porifera, Spongiaria) und Radiolarien die sich durch enzymkatalysierte Kondensation von Orthokieselsäure Si(OH)4 ein Exoskelett aus Siliciumdioxid aufbauen.
Auch viele Pflanzen enthalten in ihren Stängeln und Blättern Siliciumdioxid. Bekannte Beispiele sind hier der Schachtelhalm und die Bambuspflanze. Durch das aufgebaute Siliciumdioxidgerüst erhalten diese zusätzliche Stabilität.
Physiologische Bedeutung für den Menschen
Silicium scheint für Knochenbildung und -reifung benötigt zu werden. Bei Kälbern führte die Gabe von Orthosilicat zur Vermehrung von Kollagen in Haut und Knorpel.[21] Die aus Tierversuchen abgeleitete wünschenswerte Zufuhr liegt bei 30 mg/d. Mangelzustände beim Menschen sind bisher nicht bekannt.
Als Kieselerde oder Silicea terra werden Präparate zum Einnehmen angeboten. Sie enthalten im Wesentlichen Kieselsäureanhydride (Siliciumdioxid) und sollen Haut, Nägel, Knochen und Bindegewebe stärken und gesund erhalten. Eine Wirkung ist wissenschaftlich nicht nachgewiesen.
Ein Überschuss an Silicium kann zur Hämolyse von Erythrocyten führen und als direkte Folge Zellveränderungen verursachen.[22]
Gewinnung im Labor

Metallurgisches Siliciumpulver
Elementares Silicium kann im Labormaßstab durch Reduktion, ausgehend von Siliciumdioxid oder Siliciumtetrafluorid, mit unedlen Metallen gewonnen werden. Bei Reaktion 2.) handelt es sich um ein aluminothermisches Verfahren, das jedoch nur unter Zusatz von elementarem Schwefel funktioniert, die dritte Route entspricht der Elemententdeckung:
- 1.) SiO2+2 Mg⟶Si+2 MgO{displaystyle 1.) mathrm {SiO_{2}+2 Mglongrightarrow Si+2 MgO} }
- 2.) 3 SiO2+4 Al⟶3 Si+2 Al2O3{displaystyle 2.) mathrm {3 SiO_{2}+4 Allongrightarrow 3 Si+2 Al_{2}O_{3}} }
- 3.) 3 SiF4+4 Al⟶3 Si+4 AlF3{displaystyle 3.) mathrm {3 SiF_{4}+4 Allongrightarrow 3 Si+4 AlF_{3}} }
Hochreaktives amorphes Silicium kann durch Reduktion mit Natrium oder Acidolyse von Siliciden erhalten werden:
- 1.) SiCl4+4 Na⟶Si+4 NaCl{displaystyle 1.) mathrm {SiCl_{4}+4 Nalongrightarrow Si+4 NaCl} }
- 2.) CaSi2+2 HCl⟶2 Si+CaCl2+H2{displaystyle 2.) mathrm {CaSi_{2}+2 HCllongrightarrow 2 Si+CaCl_{2}+H_{2}} }
Gewinnung in der Industrie
Elementares Silicium findet in unterschiedlichen Reinheitsgraden Verwendung in der Metallurgie (Ferrosilicium), der Photovoltaik (Solarzellen) und in der Mikroelektronik (Halbleiter, Computerchips). Demgemäß ist es in der Wirtschaft gebräuchlich, elementares Silicium anhand unterschiedlicher Reinheitsgrade zu klassifizieren. Man unterscheidet Simg (metallurgical grade, Rohsilicium, 98–99 % Reinheit), Sisg (solar grade, Solarsilicium, Verunreinigungen kleiner 0,01 %) und Sieg (electronic grade, Halbleitersilicium, Verunreinigungen kleiner 10−9). Für Solarzellen ist die Reinheit des Materials in seiner gesamten Stärke wichtig, um eine möglichst lange Ladungsträger-Lebensdauer zu gewährleisten, für viele Anwendungen in der Mikroelektronik müssen nur die oberen Schichten von etwa 20 bis 30 µm hochrein sein.
Traditionell wird das Siemens-Verfahren eingesetzt, bei dem das Silicium zunächst mit gasförmigem Chlorwasserstoff bei 300–350 °C in einem Wirbelschichtreaktor zu Trichlorsilan (Silicochloroform) umgesetzt wird.
- Si+3 HCl⟶H2+HSiCl3{displaystyle mathrm {Si+3 HCllongrightarrow H_{2}+HSiCl_{3}} }
Nach mehreren Destillationsschritten wird das Trichlorsilan in Anwesenheit von Wasserstoff in einer Umkehrung der obigen Reaktion an beheizten Reinstsiliciumstäben bei 1000–1200 °C wieder thermisch zersetzt.[23] Das elementare Silicium wächst dabei auf die Stäbe auf. Der dabei freiwerdende Chlorwasserstoff wird in den Kreislauf zurückgeführt. Als Nebenprodukt fällt Siliciumtetrachlorid an, das entweder zu Trichlorsilan umgesetzt und in den Prozess zurückgeführt oder in der Sauerstoffflamme zu pyrogener Kieselsäure verbrannt wird. Beim Siemensverfahren entstehen pro kg Reinstsilicium 19 kg Abfall- und Nebenstoffe.
Rohsilicium
Im industriellen Maßstab wird elementares Silicium durch die Reduktion von Siliciumdioxid mit Kohlenstoff im Schmelz-Reduktionsofen bei Temperaturen von etwa 2000 °C gewonnen. Ausgangsmaterial ist Quarzsand oder Quarzkies.
- SiO2+2 C⟶Si+2 CO{displaystyle mathrm {SiO_{2}+2 Clongrightarrow Si+2 CO} }
Von diesem industriellen Rohsilicium (Simg) wurden im Jahre 2002 etwa 4,1 Millionen Tonnen hergestellt. Es ist für metallurgische Zwecke ausreichend sauber und findet Verwendung als Legierungsbestandteil und Desoxidant für Stähle (Verbesserung der Korrosionsbeständigkeit, Unterdrückung von Zementit) sowie als Ausgangsstoff für die Silanherstellung über das Müller-Rochow-Verfahren, die schließlich vor allem zur Herstellung von Silikonen dienen. Zur Herstellung von Ferrosilicium für die Stahlindustrie (Desoxidationsmittel im Hochofenprozess) wird zweckmäßigerweise nachfolgende Reaktion unter Anwesenheit von elementarem Eisen durchgeführt.
- SiO2+2 C+Fe⟶FeSi+2 CO{displaystyle mathrm {SiO_{2}+2 C+Felongrightarrow FeSi+2 CO} }
Weitere Aufschlussmöglichkeiten von SiO2 sind:
Der Sodaaufschluss bei ca. 1600 °C in der Schmelzwanne:
- 4 SiO2+Na2CO3⟶Na2O⋅4 SiO2 + CO2{displaystyle mathrm {4 SiO_{2}+Na_{2}CO_{3}longrightarrow Na_{2}Ocdot 4 SiO_{2} + CO_{2}} }
Der Hydrothermalaufschluss bei ca. 200 °C mit Wasser im Autoklaven:
- 2 SiO2+2 NaOH⟶Na2O⋅2 SiO2+ H2O{displaystyle mathrm {2 SiO_{2}+2 NaOHlongrightarrow Na_{2}Ocdot 2 SiO_{2}+ H_{2}O} }
Solarsilicium

Polykristallines Solarsilicium
Für die Produktion von Solarzellen muss das Rohsilicium weiter zum Solarsilicium (Sisg) gereinigt werden. Dafür gibt es verschiedene Verfahren. Diese Verfahren sind aufgrund der vielen aufwändigen Zwischenschritte der energieintensivste Teil bei der Herstellung von Solarmodulen. Daher werden inzwischen verschiedene Herstellungsmethoden wie das UMG-Verfahren (Upgraded Metallurgical Grade) und das FBR-Verfahren (Fluidized Bed Reactor) erprobt und eingesetzt.[24]
Eine chlorfreie Alternative stellt die Zersetzung von Monosilan dar, das nach einem Reinigungsschritt an beheizten Oberflächen oder beim Durchleiten durch Wirbelschichtreaktoren wieder zerfällt.[25]
- SiH4⟶2 H2+Si{displaystyle mathrm {SiH_{4}longrightarrow 2 H_{2}+Si} }
Das auf diesen Wegen erhaltene polykristalline Silicium (Polysilicium) ist für die Herstellung von Solarmodulen geeignet und besitzt eine Reinheit von über 99,99 %. In der Solartechnik werden genau wie beim Einsatz in der Mikroelektronik die halbleitenden Eigenschaften des Siliciums ausgenutzt.
Nur noch von historischem Interesse ist ein Verfahren, das früher von der Firma DuPont angewendet wurde. Es basierte auf der Reduktion von Tetrachlorsilan mit elementarem Zinkdampf bei Temperaturen von 950 °C.[26]
- SiCl4+2 Zn⟶Si+2 ZnCl2{displaystyle mathrm {SiCl_{4}+2 Znlongrightarrow Si+2 ZnCl_{2}} }
Aufgrund technischer Probleme und dem in großen Mengen anfallenden Zinkchloridabfall wird dieses Verfahren jedoch heute nicht mehr angewendet.
Halbleitersilicium

Monokristallines Halbleitersilicium
Für Anwendungen in der Mikroelektronik wird hochreines, monokristallines Silicium (Sieg) benötigt. Insbesondere Verunreinigungen mit Elementen, die auch als Dotierelemente geeignet sind, müssen durch Tiegelziehen oder Zonenschmelzen auf Konzentrationen unterhalb bestimmter kritischer Werte gebracht werden. Der Hersteller Shin-Etsu bewirbt eine „11N“-Reinheit (= 99,999 999 999 %) seiner Ingots.[27]
Beim Tiegelziehen (Czochralski-Verfahren) wird das im Siemensverfahren erhaltene Solarsilicium in Quarztiegeln geschmolzen. Ein Impfkristall aus hochreinem, monokristallinem Silicium wird in diese Schmelze gebracht und langsam unter Drehen aus der Schmelze herausgezogen, wobei hochreines Silicium in monokristalliner Form auf dem Kristall auskristallisiert und dadurch fast alle Verunreinigungen in der Schmelze zurückbleiben. Physikalischer Hintergrund dieses Reinigungsverfahrens ist die Schmelzpunkterniedrigung und Neigung von Stoffen, möglichst rein zu kristallisieren.
Alternativ wird beim Zonenschmelzen mit Hilfe einer (ringförmigen) elektrischen Induktionsheizung eine Schmelzzone durch einen Siliciumstab gefahren, wobei sich ein Großteil der Verunreinigungen in der Schmelze löst und mitwandert.
Hochreines kristallines Silicium ist derzeit das für die Mikroelektronik am besten geeignete Grundmaterial; weniger hinsichtlich seiner elektrischen Eigenschaften als vielmehr wegen der chemischen, physikalischen und technisch nutzbaren Eigenschaften von Silicium und seiner Verbindungen (Siliciumdioxid, Siliciumnitrid usw.). Alle gängigen Computerchips, Speicher, Transistoren etc. verwenden hochreines Silicium als Ausgangsmaterial. Diese Anwendungen beruhen auf der Tatsache, dass Silicium ein Halbleiter ist. Durch die gezielte Einlagerung von Fremdatomen (Dotierung), wie beispielsweise Indium, Antimon, Arsen, Bor oder Phosphor, können die elektrischen Eigenschaften von Silicium in einem weiten Bereich verändert werden. Dadurch lassen sich verschiedenste elektronische Schaltungen realisieren. Wegen der zunehmenden Bedeutung der elektronischen Schaltungen spricht man auch vom Silicium-Zeitalter. Auch die Bezeichnung Silicon Valley („Silicium-Tal“) für die Hightech-Region in Kalifornien weist auf die enorme Bedeutung des Siliciums in der Halbleiter- und Computerindustrie hin.
Amorphes Silicium kann mit Hilfe von Excimerlasern in polykristallines Silicium umgewandelt werden. Dies ist für die Herstellung von Dünnfilmtransistoren (Thin-Film-Transistor, TFT) für Flachbildschirme von zunehmender Bedeutung.

Silicium-Wafer
Hersteller
Silicium ist im Handel sowohl als feinkörniges Pulver als auch in größeren Stücken erhältlich.
Hochreines Silicium für die Anwendung in Solarmodulen oder in Halbleiterkomponenten wird in der Regel in Form von dünnen Scheiben aus Einkristallen, sogenannten Silicium-Wafern (siehe Abb.), produziert. Aufgrund der hohen Anfangsinvestitionen und langen Bauzeiten für die notwendigen Öfen stellen allerdings weltweit nur wenige Firmen Rohsilicium her.
Die größten Produzenten für metallurgisches Silicium sind:
Elkem (N, USA)
Invensil (F, USA)[28]
Globe Metallurgical (USA)
Rima Metal (Br)
Es gibt noch ca. 15 andere große Produzenten. In der Volksrepublik China gibt es eine Reihe kleinerer Werke, im Ländervergleich ist sie daher der größte Produzent.[29]
Der Markt für Polysilicium bzw. Reinstsilicium ist seit Mitte der 2000er Jahre im Umbruch. Aufgrund des hohen Bedarfes der Solarbranche kam es schon 2006 zu einer Siliciumknappheit,[30] und nachdem Polysilicium aufgrund der hohen Nachfrage in den Jahren 2008/2009 nicht mehr in ausreichender Menge verfügbar war, stieg sein Preis so stark, dass eine ganze Reihe von Firmen dazu überging, eigene neue Produktionsanlagen zu errichten. Aber auch die etablierten Hersteller (siehe unten) erweiterten ihre Kapazitäten stark, ganz zu schweigen von zahlreichen völlig neuen Anbietern, vor allem aus Asien, so dass die Frage, welcher dieser Hersteller am Ende in der Lage sein würde, seine Anlagen beizeiten in Betrieb zu nehmen und bei nun wieder stark gefallenen Preisen noch profitabel zu produzieren, zum Ende des Jahrzehnts schwer zu beantworten war[31][32] und auch weiterhin unterschiedlich beantwortet wird.
| Hersteller | erwartete Produktionskapazität im Jahr 2010 | Firmensitz |
|---|---|---|
| Hemlock Semiconductor | 36 kt[33] | USA |
| Wacker Chemie | 33 kt[34] | Deutschland |
| GCL-Poly | 18 kt[35] | China (Hongkong) |
| OCI | 17 kt[36] | Südkorea |
| MEMC Electronic Materials | 08 kt[37] | USA |
| Renewable Energy Corporation ASA (REC) | 12 kt[38] | Norwegen |
| Tokuyama | 08,2 kt[39] | Japan |
Eigenschaften
Physikalische Eigenschaften
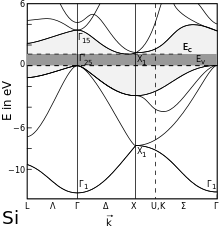
Erweitertes Zonenschema von Silicium (nicht besetzte Bereiche eingefärbt)
Silicium ist wie die im Periodensystem benachbarten Germanium, Gallium, Phosphor und Antimon ein Elementhalbleiter. Der gemäß dem Bändermodell geltende energetische Abstand zwischen Valenzband und Leitungsband beträgt 1,107 eV (bei Raumtemperatur). Durch Dotierung mit geeigneten Dotierelementen wie beispielsweise Bor oder Arsen kann die Leitfähigkeit um einen Faktor 106 gesteigert werden. In solchermaßen dotiertem Silicium ist die durch die von Fremdatomen und Gitterdefekten verursachte Störstellenleitung deutlich größer als die der Eigenleitung, weshalb derartige Materialien als Störstellenhalbleiter bezeichnet werden. Der Gitterparameter beträgt 543 pm.

Spektrum des komplexen Brechungsindex (N = n + i k) von Silicium
Der von der Wellenlänge des Lichts abhängige komplexe Brechungsindex ist im nebenstehenden Bild dargestellt.[40][41] Auch hier lassen sich Informationen über die Bandstruktur ablesen. So erkennt man anhand des stark steigenden Verlaufs des Extinktionskoeffizienten k einen direkten Bandübergang bei 370 nm (EΓ1 = 3,4 eV). Ein weiterer direkter Bandübergang ist bei ≈ 300 nm (EΓ2 = 4,2 eV) zu beobachten. Der indirekte Bandübergang von Silicium (Eg = 1,1 eV) kann nur erahnt werden. Dass weitere indirekte Bandübergänge vorhanden sind, ist an der weit auslaufenden Kurve von k für Wellenlängen > 400 nm erkennbar.
Wie Wasser und einige wenige andere Stoffe weist Silicium eine Dichteanomalie auf: Seine Dichte ist in flüssiger Form (bei Tm = 1685 K) um 10–11 %[42] höher als in fester, kristalliner Form (c-Si) bei 300 K.
Chemische Eigenschaften
In allen in der Natur auftretenden und in der überwiegenden Zahl der synthetisch hergestellten Verbindungen bildet Silicium ausschließlich Einfachbindungen aus. Die Stabilität der Si-O-Einfachbindung im Gegensatz zur C-O-Doppelbindung ist auf ihren partiellen Doppelbindungscharakter zurückzuführen, der durch Überlappung der freien Elektronenpaare des Sauerstoffs mit den leeren d-Orbitalen des Siliciums zustande kommt.
Die lange Jahre als gültig angesehene Doppelbindungsregel, wonach Silicium als Element der 3. Periode keine Mehrfachbindungen ausbildet, muss mittlerweile jedoch als überholt angesehen werden, da inzwischen eine Vielzahl synthetisch hergestellter Verbindungen mit Si-Si-Doppelbindungen bekannt sind. Im Jahre 2004 wurde die erste Verbindung mit einer formalen Si-Si-Dreifachbindung strukturell charakterisiert.
Mit Ausnahme von salpetersäurehaltiger Flusssäure (in der sich Hexafluorosilicat bildet) ist Silicium in Säuren unlöslich, da es zur Passivierung durch die Bildung einer festen Siliciumdioxid-Schicht kommt.[43] Leicht löst es sich hingegen in heißen Alkalilaugen unter Wasserstoffbildung.[44] Trotz seines negativen Normalpotenzials (−0,81 V) ist es in kompakter Form relativ reaktionsträge, da es sich an der Luft mit einer schützenden Oxidhaut überzieht.
Mechanische Eigenschaften
Die mechanischen Eigenschaften von Silicium sind anisotrop (richtungsabhängig).[45][46] Je nach gewählter Kristallorientierung nimmt der Elastizitätsmodul Werte zwischen 130 GPa und 189 GPa an. Eine allgemeine Beschreibung des elastischen Verhaltens erfolgt in Voigt-Notation wie für alle kubischen Kristalle über die drei unabhängigen elastischen Konstanten C11, C12 und C44. Die Elastizitätsmatrix ist für Silicium:
- C=(C11C12C12000C12C11C12000C12C12C11000000C44000000C44000000C44){displaystyle C={begin{pmatrix}C_{11}&C_{12}&C_{12}&0&0&0\C_{12}&C_{11}&C_{12}&0&0&0\C_{12}&C_{12}&C_{11}&0&0&0\0&0&0&C_{44}&0&0\0&0&0&0&C_{44}&0\0&0&0&0&0&C_{44}\end{pmatrix}}}
Die elastischen Konstanten haben dabei folgende Werte:
- C11=165,7GPa,C12=63,9GPa,C44=79,6GPa{displaystyle C_{11}=165{,}7,mathrm {GPa} ,qquad C_{12}=63{,}9,mathrm {GPa} ,qquad C_{44}=79{,}6,mathrm {GPa} }
Aus den elastischen Konstanten lassen sich für die einzelnen Hauptkristallrichtungen des Siliciums (100,110 und 111) die jeweiligen Elastizitätsmoduln errechnen:
- E100=C11−2C12C11+C12C12≈130GPa{displaystyle E_{100}=C_{11}-2{frac {C_{12}}{C_{11}+C_{12}}}C_{12}approx 130,mathrm {GPa} }
- E110=4(C112+C12C11−2C122)C442C44C11+C112+C12C11−2C122≈170GPa{displaystyle E_{110}=4{frac {(C_{11}^{2}+C_{12}C_{11}-2C_{12}^{2})C_{44}}{2C_{44}C_{11}+C_{11}^{2}+C_{12}C_{11}-2C_{12}^{2}}}approx 170,mathrm {GPa} }
- E111=3C44(C11+2C12)C11+2C12+C44≈189GPa{displaystyle E_{111}=3{frac {C_{44}(C_{11}+2C_{12})}{C_{11}+2C_{12}+C_{44}}}approx 189,mathrm {GPa} }
Isotope
Es sind insgesamt 23 Isotope zwischen 22Si und 45Si des Siliciums bekannt. Von diesen sind drei, die Isotope 28Si, 29Si und 30Si, stabil und kommen in der Natur vor. Das Isotop mit dem größten Anteil an der natürlichen Isotopenzusammensetzung ist 28Si mit 92,223 %, 29Si hat einen Anteil von 4,685 % und 30Si von 3,092 %. Die langlebigsten instabilen Isotope sind 32Si, das mit einer Halbwertszeit von 153 Jahren unter Betazerfall in 32P (Phosphor) übergeht und 31Si, das mit einer Halbwertszeit von 157,36 Minuten ebenfalls unter Betazerfall zu 31P zerfällt. Alle anderen Isotope haben nur kurze Halbwertszeiten von Sekunden oder Millisekunden.[47]
28Si entsteht in schweren Sternen gegen Ende ihrer Entwicklung in großen Mengen (Sauerstoffbrennen). Dies ist der Grund für den hohen Anteil von 28Si am gesamten Silicium (92,23 %) bzw. auch an der Häufigkeit von Silicium im Vergleich zu anderen Elementen. Derzeit (2009) wird versucht, die SI-Basiseinheit Kilogramm neu zu definieren als eine bestimmte Menge von 28Si-Atomen. Ebenfalls stabil sind die Isotope 29Si (4,67 % Anteil am gesamten Silicium) sowie 30Si (3,1 %).
Das radioaktive Isotop 31Si zerfällt rasch (Halbwertszeit 157,3 Minuten) durch Beta-Strahlung zu stabilem Phosphor. Dieser Umstand kann genutzt werden, um sehr homogen n-dotiertes Silicium herzustellen. Dazu wird Silicium mit Neutronen bestrahlt, durch Neutroneneinfang entsteht dann 31Si und folglich 31P. Eine für dieses Verfahren geeignete Neutronenquelle ist die Forschungs-Neutronenquelle Heinz Maier-Leibnitz. Langlebiger ist 32Si mit einer Halbwertszeit von 172 Jahren. Spuren dieses Isotops entstehen in der Erdatmosphäre durch Spallation von Argon durch kosmische Strahlung. 32Si zerfällt zu dem ebenfalls radioaktiven 32P (Halbwertszeit 14,3 Tage), und dann weiter zu stabilem 32S (Schwefel). Alle weiteren Isotope zerfallen innerhalb weniger Sekunden (vgl. Liste der Isotope).
Sicherheit
Silicium ist als Pulver wie viele Elemente brennbar. Als Pulver und Granulat ist es reizend. Kompaktes Silicium ist ungefährlich.
Hydriertes, das heißt oberflächlich mit Wasserstoff bedecktes, poröses Silicium kann unter Lasereinstrahlung und Zunahme von Sauerstoff hochexplosiv sein[48][49], wie Forscher der Technischen Universität München zufällig entdeckt haben. Sprengungen im Mikrometerbereich sind möglich. Die Detonationsgeschwindigkeit und Detonationsenergie sind höher als bei TNT und Dynamit.
Verwendung in der Technik
1947 entdecken John Bardeen, Walter Brattain und William Shockley den regelbaren elektrischen Widerstand, den Transistor, zunächst an einem Germaniumkristall. Es dauerte einige Zeit, bis das verbindungsfreudige Silicium in der für Halbleitereigenschaften notwendigen Reinheit isoliert werden konnte. 1958 entwickeln Robert Noyce bei Fairchild und Jack S. Kilby bei Texas Instruments unabhängig voneinander die integrierte Schaltung (IC) auf einem Silicium-Chip.[50] Heutzutage stellt Silicium das Grundmaterial der meisten Produkte der Halbleiterindustrie dar. So dient es auch als Basismaterial für viele Sensoren und andere mikromechanische Systeme (z. B. Hebelarm in einem Rasterkraftmikroskop). Silicium ist ebenfalls der elementare Bestandteil der meisten Solarzellen.
Im November 2005 wurde von ersten erfolgversprechenden Versuchsergebnissen mit Siliciumlasern berichtet.
Silicium wird als energiereicher Brennstoff in vielen Explosivstoffen verwendet.[48]
Da sich Silicium beim Erstarren ausdehnt, während sich die meisten Stoffe zusammenziehen, wird es vielen Gusslegierungen zulegiert. Gusseisen enthält beispielsweise immer etwa 2 % Si. Besondere Bedeutung haben Aluminium-Silicium-Legierungen, in denen der Si-Gehalt bis 20 % betragen kann. Dies ist von allen Aluminiumgusswerkstoffen die wichtigste Sorte.[51][52]
Verbindungen

Quarzkristall

Siliciumcarbid
Silicium tritt in chemischen Verbindungen fast immer vierwertig auf. Demgemäß ist das Siliciumatom in Verbindungen in der Regel vierfach koordiniert. Daneben existieren aber mittlerweile eine Reihe von Verbindungen, in denen Silicium eine fünf- oder sechsfache Koordination aufweist.
Neben dem vierwertigen Silicium sind auch synthetisch hergestellte Verbindungen des zweiwertigen Siliciums (Silylene) bekannt, die jedoch meistens sehr instabil sind. Von größerer Bedeutung ist einzig das Siliciummonoxid, das als Material zur Vergütung von optischen Linsen verwendet wird.
Darüber hinaus wurde 2012 auch eine dreifach koordinierte Verbindung ähnlich der eindimensionalen Struktur von Graphen experimentell nachgewiesen, dem sogenannten Silicen.[53]
Die gesamte Chemie des Siliciums ist im Wesentlichen durch die hohe Affinität des Siliciums zum Sauerstoff geprägt.
Silicium stellt in aller Regel den elektropositiven Partner einer chemischen Verbindung dar, obwohl auch Verbindungen mit formal negativiertem Silicium existieren. Dabei handelt es sich meistens um Silicide, bei denen Silicium auch echte Anionen ausbilden kann.
Inversion der Bindungspolarität
Besonders erwähnenswert ist die Inversion der Bindungspolarität von Element-Wasserstoff-Bindungen beim Übergang von Kohlenstoff zum Silicium. Hier ändert sich die Elektronegativitätsdifferenz von +0,45 (Kohlenstoff-Wasserstoff) auf −0,2, weshalb Siliciumwasserstoffverbindungen eine gänzlich andere Reaktivität als Kohlenwasserstoffe aufweisen.
Die wichtigsten Verbindungen des Siliciums kann man in folgende Klassen einteilen, von denen jeweils einige Vertreter genannt sind:
Binäre Verbindungen
- Siliciumcarbid
- Siliciumdioxid
- Siliciumnitrid
- Silicide
Silicate
Zirkon und alle anderen Silicate und Verbindungen der Kieselsäure
Siliciumhalogenide
- Siliciumtetrafluorid
- Siliciumtetrachlorid
Trichlorsilan (Silicochloroform)
Siliciumwasserstoffe
- Monosilan
- Silane
Organische Siliciumverbindungen
Tetramethylsilan (TMS, NMR-Standard)
Methylchlorsilane wie Dichlormethylsilan (Bausteine für Silikone)- Phenylchlorsilan
- Carbosilane
- Carbosilazane
- Carbosiloxane
Polymere Siliciumverbindungen
- Silikone (Silicone, Polyorganosiloxane) entstehen durch Polymerisation und gehören zu den wichtigsten industriellen Kunststoffen gehören. Polymere Silicium-Sauerstoff-Verbindungen finden Anwendung in vielen Bereichen; so dienen sie als Schmiermittel und Dichtstoffe in der Kosmetik- und Bauindustrie.
- Polysilane, -carbosilane, -carbosilazane, -carbosiloxane
Sonstiges
Bis heute kommt es immer wieder vor, dass das englische Wort „silicon“ (für Silicium) in populärwissenschaftlichen Artikeln oder bei Filmsynchronisationen fälschlich als „Silikon“ (engl. „silicone“) übersetzt bzw. ausgesprochen wird. Dies geschah beispielsweise in der Science-Fiction-Serie Star Trek, dem James-Bond-Agententhriller Im Angesicht des Todes oder in der Zeichentrickserie Die Simpsons. Beispiel: „Besteht die Lebensform aus Kohlenstoff oder aus Silikon?“[54]
Sogar in nicht übersetzten Texten wie dem 1980er-Jahre-Hit Monopoli fiel Songschreiber und Interpret Klaus Lage auf die falsche Verwendung herein, denn er textete: „[…] deinen Job macht jetzt ein Stück Silikon […]“.
Siehe auch
- Gestrecktes Silicium
- Schwarzes Silicium
- Siliziumtombak
- Amorphes Silicium
Literatur
- Tracy L. Simpson, Benjamin E. Volcani: Silicon and siliceous structures in biological systems. Springer-Verlag, New York 1981, ISBN 3-540-90592-8.
- Thomas Thomson: On the Daltonian Theory of Definite Proportions in Chemical Combinations. In: Annals of Philosophy. Band 2, 1813, S. 32.
Weblinks
Einzelnachweise
↑ ab Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3.
↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Silicium) entnommen.
↑ Angegeben ist der von der IUPAC empfohlene Standardwert, da die Isotopenzusammensetzung dieses Elements örtlich schwanken kann, ergibt sich für das mittlere Atomgewicht der in Klammern angegebene Massenbereich. Siehe: Michael E. Wieser, Tyler B. Coplen: Atomic weights of the elements 2009 (IUPAC Technical Report). In: Pure and Applied Chemistry. 2010, S. 1, doi:10.1351/PAC-REP-10-09-14.
↑ IUPAC, Standard Atomic Weights Revised 2013.
↑ N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1988, ISBN 3-527-26169-9, S. 426.
↑ Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145 (Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert).
↑ ab Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
↑ W. Zulehner, B. Neuer, G. Rau: Silicon. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2005, doi:10.1002/14356007.a23_721.
↑ ab Eintrag zu Silicium in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. April 2017 (JavaScript erforderlich).
↑ Schweizerische Unfallversicherungsanstalt (SUVA): Grenzwerte am Arbeitsplatz 2015 – MAK-Werte, BAT-Werte, Grenzwerte für physikalische Einwirkungen, abgerufen am 2. November 2015.
↑ N. Figurowski: Die Entdeckung der chemischen Elemente und der Ursprung ihrer Namen. Aulis-Verlag Deubner, Köln 1981, ISBN 3-7614-0561-8, S. 142–143.
↑ Antoine-Laurent de Lavoisier: Traité élémentaire de chimie: présenté dans un ordre nouveau et d'après les découvertes modernes .... Chez Cuchet, 1789, S. 174–.
↑ Antoine Laurent Lavoisier: Elements of Chemistry: In a New Systematic Order; Containing All the Modern Discoveries. Mathew Carey, 1799, S. 218–.
↑ Humphrey Davy: Electro-Chemical Researches, on the Decomposition of the Earth; with Observations on the Metals obtained from the alkaline Earths, and on the Amalgam procured from Ammonia. In: W. Bowyer and J. Nichols for Lockyer Davis, printer to the Royal Society (Hrsg.): Philosophical Transactions of the Royal Society of London. 30. Juni 1808, S. 333– (eingeschränkte Vorschau in der Google-Buchsuche).
↑ Joseph-Louis Gay-Lussac, Louis Jacques Thénard: Recherches physico-chimiques, faites sur la pile; sur la préparation chimique et les propriétés du potassium et du sodium; sur la décomposition de l'acide boracique; sur les acides fluorique; muriatique et muriatique oxigéné; sur l'action chimique de la lumière; sur l'analyse végétale et animale; etc. Hrsg.: Deterville. Band 1, 1811, S. 313– (eingeschränkte Vorschau in der Google-Buchsuche).
↑ Joseph-Louis Gay-Lussac, Louis Jacques Thénard: Recherches physico-chimiques, faites sur la pile; sur la préparation chimique et les propriétés du potassium et du sodium; sur la décomposition de l'acide boracique; sur les acides fluorique; muriatique et muriatique oxigéné; sur l'action chimique de la lumière; sur l'analyse végétale et animale; etc. Hrsg.: Deterville. Band 2, 1811, S. 55– (eingeschränkte Vorschau in der Google-Buchsuche).
↑ Mary Elvira Weeks: Discovery of the Elements. 6th ed. Journal Of Chemical Education, Detroit 1960, S. 586–588 (Internet Archive).
↑ Thomas Thomson: A System of Chemistry in Four Volumes. 5. Ausgabe, Band 1, Baldwin, Cradock, and Joy, London 1817, S. 252 (eingeschränkte Vorschau in der Google-Buchsuche).
↑ Webmineral – Mineral Species sorted by the element Si (Silicon).
↑ Mindat - Silicon.
↑ M. R. Calomme, D. A. Vanden Berghe: Supplementation of calves with stabilized orthosilicic acid: Effect on the Si, Ca, Mg, and P concentrations in serum and the collagen concentration in skin and cartilage. In: Biological Trace Element Research. Band 56, Nr. 2, 1997, S. 153–165, doi:10.1007/BF02785389.
↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 880.
↑ Erhard Sirtl, Konrad Reuschel: Über die Reduktion von Chlorsilanen mit Wasserstoff. In: Zeitschrift für anorganische und allgemeine Chemie. Band 332, Nr. 3–4, Oktober 1964, S. 113–123, doi:10.1002/zaac.19643320302 (PDF).
↑ William Vorsatz: Große gewinnen, Zeitschrift photovoltaik, Ausgabe: 07-2009
↑ Hermann Sicius: Kohlenstoffgruppe: Elemente der vierten Hauptgruppe Eine Reise durch das Periodensystem. Springer-Verlag, 2015, ISBN 978-3-658-11166-3, S. 21 (eingeschränkte Vorschau in der Google-Buchsuche).
↑ Marcello Pirani: Elektrothermie Die elektrische Erzeugung und technische Anwendung hoher Temperaturen. Springer-Verlag, 2013, ISBN 978-3-642-92778-2, S. 129 (eingeschränkte Vorschau in der Google-Buchsuche).
↑ ShinEtsu.co.jp: Reinheitsangabe '99,999999999%'
↑ metalbulletin.com: Invensil to cut silicon production – 18. Dezember 2001
↑ Minerals Yearbook: Silicon (Staatlicher US-Geo-Infoservice).
↑ Jürgen Kuri: Solarbranche sorgt für Siliziumknappheit. In: heise-online. 14. Juni 2006, abgerufen am 4. Dezember 2008 (Marktbericht).
↑ Robert Schramm, Lauren Licuanan: Feedback form Solar Silicon Conference. 28. April 2010.
↑ Timothy Lam: Asia Solar View – May 2010. 3. Mai 2010.
↑ Hemlock Semiconductor Facts and Figures. Abgerufen am 6. Mai 2010.
↑ Presseportal Wacker Chemie Kapazität Polysilicon. Abgerufen am 10. Oktober 2011.
↑ GCL-Poly at a glance. (Memento vom 18. Januar 2011 im Internet Archive)
↑ The Future of Silicon OCI Company Ltd.
↑ MEMC - About MEMC. Abgerufen am 6. Mai 2010.
↑ REC Group. Abgerufen am 6. Mai 2010.
↑ Tokuyama plans new Malaysian polysilicon plant. Abgerufen am 6. Mai 2010.
↑ Christiana Honsberg, Stuart Bowden: Optical Properties of Silicon. Abgerufen am 18. Juni 2007.
↑ Edward D. Palik, Gorachand Ghosh: Handbook of optical constants of solids. Academic Press, San Diego 1998, ISBN 0-12-544420-6.
↑ A. Hedler: Plastische Deformation von amorphem Silizium unter Hochenergie-Ionenbestrahlung. Dissertation. 2006, S. 27 (urn:nbn:de:gbv:27-dbt-005950-2).
↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 922.
↑ E. Riedel, C. Janiak: Anorganische Chemie. 8. Auflage. de Gruyter, Berlin/ New York 2011, S. 521.
↑ Sadao Adachi: Properties of Group-IV, III-V and II-VI Semiconductors. John Wiley & Sons, 2005, ISBN 0-470-09032-4.
↑ Jan Korvnik, Andreas Greine: Semiconductors for Micro- and Nanotechnology. Wiley-VCH, Weinheim 2005, ISBN 3-527-30257-3.
↑ G. Audi, F. G. Kondev, Meng Wang, W.J. Huang, S. Naimi: The NUBASE2016 evaluation of nuclear properties. In: Chinese Physics C. 41, 2017, S. 030001, doi:10.1088/1674-1137/41/3/030001 (Volltext).
↑ ab Ernst-Christian Koch, Dominik Clément: Special Materials in Pyrotechnics: VI. Silicon-An Old Fuel with New Perspectives. In: Propellants Explosives Pyrotechnics. Band 32, Nr. 3, 2007, S. 205–212, doi:10.1002/prep.200700021.
↑ D. Kovalev, V. Yu. Timoshenko, N. Künzner, E. Gross, F. Koch: Strong Explosive Interaction of Hydrogenated Porous Silicon with Oxygen at Cryogenic Temperatures. In: Physical Review Letters. Band 87, Nr. 6, 2001, S. 683011–683014, doi:10.1103/PhysRevLett.87.068301.
↑ Jack S. Kilby: Invention of the integrated circuit. In: IEEE Transactions on Electron Devices. Band 23, Nr. 7, 1976, S. 648–654.
↑ Bernhard Ilschner, Robert Singer: Werkstoffwissenschaften und Fertigungstechnik - Eigenschaften, Vorgänge, Technologien, Springer, 5. Auflage, 2010, S. 350
↑ Jürgen Ruge, Helmut Wohlfahrt: Technologie der Werkstoffe - Herstellung, Verarbeitung, Einsatz, Springer, 9. Auflage, 2013, S. 286.
↑ Patrick Vogt u. a.: Silicene: Compelling Experimental Evidence for Graphenelike Two-Dimensional Silicon. In: Physical Review Letters. Band 108, Nr. 15, 12. April 2012, S. 155501, doi:10.1103/PhysRevLett.108.155501.
↑ Dr. Hibbert in: Die Akte Springfield. (engl. The Springfield Files) Staffel 8, Episode 1, deutsche Erstausstrahlung 24. Oktober 1997.
.mw-parser-output div.NavFrame{border:1px solid #A2A9B1;clear:both;font-size:95%;margin-top:1.5em;min-height:0;padding:2px;text-align:center}.mw-parser-output div.NavPic{float:left;padding:2px}.mw-parser-output div.NavHead{background-color:#EAECF0;font-weight:bold}.mw-parser-output div.NavFrame:after{clear:both;content:"";display:block}.mw-parser-output div.NavFrame+div.NavFrame,.mw-parser-output div.NavFrame+link+div.NavFrame{margin-top:-1px}.mw-parser-output .NavToggle{float:right;font-size:x-small}




















