Exotherme Reaktion
Als exotherm (griechisch ἔξω exo ‚außen‘ und θερμός thermós ‚warm‘, ‚heiß‘, ‚hitzig‘) bezeichnet man eine chemische Reaktion, wenn deren Produkte eine geringere Enthalpie H{displaystyle H}

Findet die Reaktion bei konstantem Druck statt (also unter isobaren Bedingungen), ist die Enthalpieabnahme zahlenmäßig gleich der abgegebenen Wärmemenge (siehe → Enthalpie für eine nähere Erläuterung). Im isobaren Fall sind die exothermen Reaktionen also gerade diejenigen, bei denen Wärme an die Umgebung abgegeben wird.
Gelegentlich werden exotherme Reaktionen auch pauschal definiert als Reaktionen, die Wärme abgeben.[4][5] Im isobaren Fall sind beide Definitionen identisch, darüber hinaus aber im Allgemeinen nicht. Findet die Reaktion beispielsweise bei konstant gehaltenem Volumen statt, entspricht die abgegebene Wärmemenge der Änderung der inneren Energie[4] des Systems, nicht der Änderung der Enthalpie (siehe → Enthalpie für eine nähere Erläuterung). Dieser Artikel verwendet im Folgenden die eingangs benutzte Definition als Reaktion mit negativer Reaktionsenthalpie. Diese Definition hat den Vorteil, dass die Enthalpie eine Zustandsgröße ist, die Kenntnis von Anfangs- und Endzustand also ausreicht, um die Enthalpieänderung zu ermitteln. Die abgegebene Wärme hingegen ist eine Prozessgröße und es ist im Allgemeinen notwendig, auch Details über den Prozessverlauf zu wissen, um sie berechnen zu können.
Den Gegensatz zur exothermen Reaktion bildet die endotherme Reaktion, deren Reaktionsenthalpie positiv ist und die im isobaren Fall die der Enthalpiezunahme zahlenmäßig entsprechende Wärmemenge aufnimmt. Ist die betrachtete Reaktion exotherm, dann ist die Umkehrreaktion endotherm, und umgekehrt.
Falls die Reaktion in einem adiabatischen Behälter stattfindet, so dass keine Wärme mit der Umgebung ausgetauscht werden kann, führt eine exotherme Reaktion zu einer Erhöhung der Temperatur und eine endotherme Reaktion zu einer Erniedrigung der Temperatur.[6]
In der Physik bezeichnet man eine Kernreaktion, bei der Energie frei wird, als exotherm. Eine exotherme Kernfusion ist etwa das Wasserstoffbrennen, wie es in der Sonne geschieht. Ebenfalls stark exotherm ist die Kernspaltung von beispielsweise Uran.
Inhaltsverzeichnis
1 Beispiele
2 Exotherme und exergone Reaktionen
3 Ablauf
4 Einzelnachweise
Beispiele |
Typische exotherme Reaktionen sind:
- Feuer (Verbrennung) sowie
- Abbinden (= Aushärten) von Beton.
Exotherm, wenn auch in weit geringerem Maße, verläuft oft auch das Mischen von Stoffen (Mischungswärme) oder die Adsorption und Absorption von Stoffen etwa an Aktivkohle oder Zeolithen.
Exotherme und exergone Reaktionen |

Die Thermitreaktion (die Reduktion von Eisen(III)-oxid durch Aluminium) ist stark exotherm und läuft sehr heftig ab.
Es erscheint zunächst naheliegend anzunehmen, dass die exothermen Reaktionen gerade diejenigen Reaktionen seien, die freiwillig ablaufen, und dass sie umso heftiger abliefen, je mehr Wärme freigesetzt wird. In vielen Fällen verhalten sich die chemischen Reaktionen auch tatsächlich so. Diese Erfahrung führte in den Anfangsjahren der Thermochemie zur Formulierung des Prinzips von Thomsen und Berthelot. Diese empirische – aber nicht strikt gültige – Regel besagt: Werden Reaktanten unter isobaren und isothermen Bedingungen zusammengebracht, so dass eine chemische Reaktion ablaufen kann, dann ist der resultierende neue Gleichgewichtszustand dadurch gekennzeichnet, dass der zu ihm führende Prozess mehr Wärme freisetzt als jeder andere mögliche Prozess. Mit anderen Worten: Von allen möglichen Prozessen wird der am stärksten exotherme realisiert. Das Prinzip ist auch gleichbedeutend mit der Aussage, dass der realisierte Prozess den Enthalpieunterschied HAnfang−HEnde{displaystyle H_{mathrm {Anfang} }-H_{mathrm {Ende} }}

Die Existenz freiwillig ablaufender endothermer Reaktionen (beispielsweise einer verdunstenden Flüssigkeit) zeigt freilich, dass dieses Prinzip keine Allgemeingültigkeit beanspruchen kann. Das tatsächliche Kriterium ist: Es laufen genau jene Reaktionen freiwillig ab, die zu einer Zunahme der Gesamtentropie des Systems und seiner Umgebung führen. Unter isobaren und isothermen Bedingungen ist dieses Kriterium der Gesamtentropie-Maximierung gleichbedeutend mit der Minimierung der Gibbs-Energie des Systems. Eine Reaktion, welche die Gibbs-Energie des Systems verringert, heißt exergone Reaktion. Die Unterscheidung zwischen freiwillig und nicht freiwillig ablaufenden Reaktionen ist gleichbedeutend mit der Unterscheidung zwischen exergonen und endergonen Reaktionen.
Ein Beispiel für eine zwar endotherme aber trotzdem freiwillig ablaufende chemische Reaktion ist der Zerfall von Distickstofftrioxid in Stickstoffmonoxid und Stickstoffdioxid:
N2O3⟶ NO + NO2 ;ΔRH=+39,7kJ/mol,ΔRG=−1,6kJ/mol{displaystyle mathrm {N_{2}O_{3}longrightarrow NO + NO_{2} ;quad } Delta _{mathrm {R} }H=+39{,}7;mathrm {kJ/mol} ,quad Delta _{mathrm {R} }G=-1{,}6;mathrm {kJ/mol} }[8]
Die Reaktionsenthalpie ΔRH{displaystyle Delta _{mathrm {R} }H}

Die Änderung der Gibbs-Energie G=H−TS{displaystyle G=H-TS}
ΔG=ΔH−T ΔS{displaystyle Delta G=Delta H-T Delta S}.
Bei kleinen Temperaturen ist ΔG≈ΔH{displaystyle Delta Gapprox Delta H}






Wenn allerdings eine Reaktion mit einer hinreichend großen Entropiezunahme ΔS{displaystyle Delta S}



Ablauf |
Auch wenn eine Reaktion exergon ist, also aus energetischer Sicht freiwillig abläuft, ist damit noch nicht sichergestellt, dass sie auch ohne äußeren Anstoß selbstständig abzulaufen beginnt. Ein Beispiel dafür ist die Reaktion von Kohlenstoff mit Sauerstoff zu Kohlenstoffdioxid:
C + O2⟶ CO2 ;ΔRH=−393,51kJ/mol,ΔRG=−394,36kJ/mol{displaystyle mathrm {C + O_{2}longrightarrow CO_{2} ;quad } Delta _{mathrm {R} }H=-393{,}51;mathrm {kJ/mol} ,quad Delta _{mathrm {R} }G=-394{,}36;mathrm {kJ/mol} }[10]
Diese Verbrennungsreaktion ist exergon (ΔRG<0{displaystyle Delta _{mathrm {R} }G<0}
In solchen Fällen liegen die Reaktanten ursprünglich nicht in einem reaktionsfähigen Zustand vor. Oft müssen erst Bindungen aufgebrochen werden, bevor sie in neuer Anordnung wieder gebildet werden können – in diesem Fall die des O2{displaystyle mathrm {O_{2}} }
Im Falle einer exothermen Reaktion kann diese Wärmeenergie aus der Reaktion selbst stammen. Wenn die Reaktion genügend Enthalpie freisetzt, ist sie selbsterhaltend, sobald sie einmal in Gang gesetzt wurde.
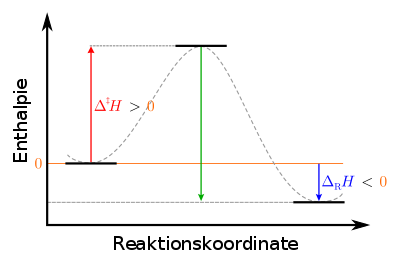 | Legende: H:=Enthalpie{displaystyle ! H:={text{Enthalpie}}}  Δ‡H:=Aktivierungsenthalpie{displaystyle ! Delta ^{ddagger }H:={text{Aktivierungsenthalpie}}}  ΔRH:=Reaktionsenthalpie{displaystyle ! Delta _{mathrm {R} }H:={text{Reaktionsenthalpie}}}  links: Ausgangszustand der Edukte: metastabil mittig: Übergangszustand des aktivierten Komplexes: instabil rechts: Endzustand der Produkte: stabil |
Für die endotherme Umkehrreaktion ist die aufzubringende Aktivierungsenthalpie größer als für die Hinreaktion, nämlich gerade die Summe aus Aktivierungsenthalpie Δ‡H{displaystyle Delta ^{ddagger }H}

Einzelnachweise |
↑ Eintrag zu exothermic reaction. In: IUPAC Compendium of Chemical Terminology (the “Gold Book”). doi:10.1351/goldbook.E02269 Version: 2.3.3.
↑ P. W. Atkins: Physikalische Chemie. 2. Nachdr. d. 1. Auflage. VCH, Weinheim 1990, ISBN 3-527-25913-9, S. 85: „Reaktionen, bei denen ΔH>0 ist, heißen endotherm, Reaktionen mit ΔH<0 heißen exotherm.“
↑ E. Keszei: Chemical Thermodynamics. Springer, Berlin/ Heidelberg 2012, ISBN 978-3-642-19863-2, S. 222: „[...] for exothermal reactions (for which ΔrH° is negative) [...] for endothermic reactions (for which ΔrH° is positive) [...]“
↑ ab Eintrag zu Enthalpie. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. Juli 2017.
↑ P.W. Atkins, J. de Paula: Physikalische Chemie. 5. Auflage, Wiley-VCH, Weinheim 2013, ISBN 978-3-527-33247-2, S. 46: „Ein Prozess, der Energie in Form von Wärme freisetzt, wird als exotherm bezeichnet. [...] Prozesse, denen Wärmeenergie zugeführt werden muss, nennt man endotherm.“
↑ P. W. Atkins: Physikalische Chemie. 2. Nachdr. d. 1. Auflage. VCH, Weinheim 1990, ISBN 3-527-25913-9, S. 85
↑ H. B. Callen: Thermodynamics and an Introduction to Thermostatistics. 2. Auflage. John Wiley & Sons, New York 1985, ISBN 0-471-86256-8, S. 277.
↑ A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 53 (Leseprobe: Teil A – Grundlagen der Chemie Der Wasserstoff. books.google.de)..
↑ H. B. Callen: Thermodynamics and an Introduction to Thermostatistics. 2. Auflage. John Wiley & Sons, New York 1985, ISBN 0-471-86256-8, S. 278.
↑ P. W. Atkins: Physikalische Chemie. 2. Nachdr. d. 1. Auflage. VCH, Weinheim 1990, ISBN 3-527-25913-9, S. 860.
↑ P. W. Atkins: Physikalische Chemie. 2. Nachdr. d. 1. Auflage. VCH, Weinheim 1990, ISBN 3-527-25913-9, S. 764.
↑ L. Pauling: General Chemistry. Dover, New York 1988, ISBN 0-486-65622-5, S. 567.